Acute Invasive Pulmonary Aspergillosis: Clinical Presentation and Treatment
- Semin Respir Crit Care Med. 2024 Feb;45(1):69-87.
- doi: 10.1055/s-0043-1777769.
- PMID: 38211628.
急性侵襲性肺アスペルギルス症のレビューがあったのでまとめます。
疫学
侵襲性肺アスペルギルス症(IPA)は、アスペルギルス属菌によって引き起こされる真菌症である。繁殖すると、空気中のアスペルギルス胞子は環境中に拡散する。
体内の抗真菌免疫の要素が機能しなくなると(遺伝性または後天性)、アスペルギルス胞子が菌糸に発芽し始め、それが下層組織や血管に侵入し(血管侵入)、血栓症、壊死、出血を引き起こす可能性がある。
侵襲性アスペルギルス症(IA)とのその他の関連は、ヒト免疫不全ウイルス感染症/後天性免疫不全症候群、コントロール不良または新規発症の糖尿病、アルコール依存症、敗血症を伴う重症患者で報告されている。
IPAの素因となる宿主因子
- 同種HCT(造血細胞移植)を受けている患者
- 急性骨髄性白血病患者で、寛解導入または強化化学療法を受けているため、長期にわたる重篤な好中球減少症の期間を経た患者
がある。
同種移植患者における IA(証明済みまたは可能性あり)の年間発生率は 7.3%(適合血縁移植)から 10.5%(HLA 不適合または非血縁移植)であり、発生率は移植後に特に増加する。
IPAのリスクを増加させるCOPD急性増悪、肝不全、重症ウイルス性肺炎
COPD急性増悪
COPD患者のIPA発症率は、1,000人あたり1.13-3.6人である。入院患者では1.3-3.9%ともされる(BMC Pulm Med. 2020;20:241.)。COPDの悪化でICUに入院し、IPAと診断された患者の場合、死亡率は30~60%と推定される。
肝不全
重度のアルコール性肝炎(SAH)と末期肝疾患(ESLD)はどちらもIPAに罹患しやすい。ESLDにおける侵襲性真菌感染症のほとんどの症例は、カンジダ属によって引き起こされる。
IAは重篤なESLD患者の5~14%に発生し、主にChild C肝硬変に発症する。SAHでは、報告されている発生率はさらに高く、16~42%程度ある。抗真菌治療にもかかわらず、予後は悪く、ほとんどのケースシリーズで死亡率は70~100%と死亡率は高い。
重症ウイルス性肺炎
重症ウイルス性肺炎における細菌の同時感染はよく知られた合併症だが、真菌の同時感染もある。インフルエンザA型またはB型ウイルス、あるいはSARS-Cov2によって引き起こされるウイルス誘発性急性呼吸窮迫症候群を呈する患者は、IPAのリスクが高く、それぞれインフルエンザ関連肺アスペルギルス症(IAPA)とCOVID-19関連肺アスペルギルス症(CAPA)につながる。IAPAは、ICU入院後平均3日で患者の19%に重複感染として発見され、総死亡率は53%と、IPAのない患者の死亡率28%を大幅に上回る(Lancet Respir Med. 2018;6:782-792.)。
臨床症状と診断
IPA は肺アスペルギルス症の急性型であり、病気の経過は数日から数週間である。発熱、痰を伴わない咳、胸膜炎性胸痛、喀血(血管侵襲の兆候として)など、かなり非特異的な幅広い症状を呈する。典型的な宿主危険因子のない機械的人工呼吸器患者では、適切な抗生物質療法と人工呼吸器サポートにもかかわらず呼吸不全の悪化や原因不明の発熱がみられる場合も、IPAの存在の兆候である可能性がある。
呼吸器官のコロニー化から始まり、気管支と細気管支への菌糸侵入、血管侵入とその後の他の臓器への拡散に至る、疾患スペクトルの連続体の一部である。
血管侵襲性肺アスペルギルス症は、好中球がアスペルギルス菌糸の殺菌に必須であるため、重度で長期にわたる好中球減少症の患者に典型的に見られる。非好中球減少性IPA患者は、血管浸潤よりも組織浸潤が多く、症状が目立たず、病気の進行が遅い傾向がある。
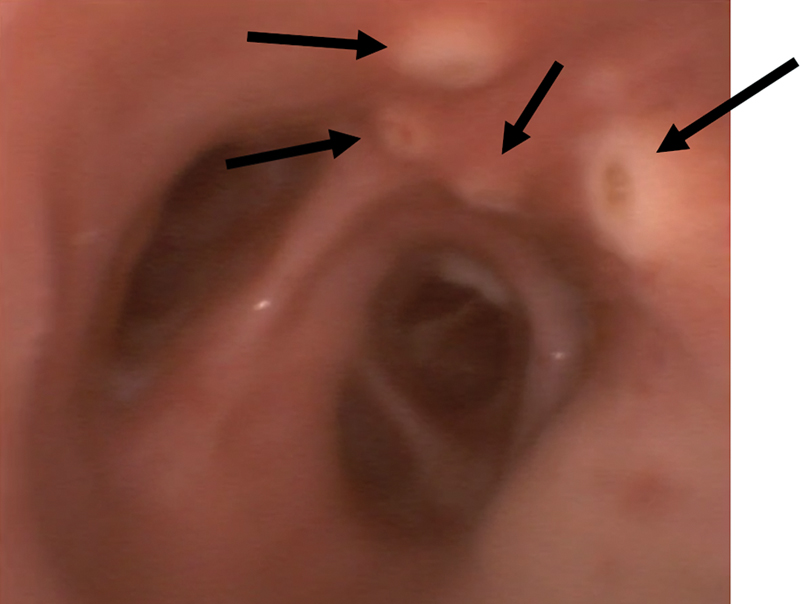
侵襲性アスペルギルス気管気管支炎(IATB)はウイルス関連肺アスペルギルス症(VAPA) の重症患者や肺移植後に典型的に見られるが、頻度は低い。IATBはIPAの病勢が強いタイプであり死亡率は80%を超えるともされる。IATBの画像所見は見られないか、非常に微妙な場合があるため、診断は通常、気管支鏡検査で、潰瘍形成、結節、偽膜、プラークを認める(下記Figは中心部に潰瘍を伴う白色結節)。IAPA 患者の最大 25~50% に、CAPA 患者の 10~20% に IATB がみられる可能性あり。
画像診断
ESCMID-ECMM-ERS(2017)および米国感染症学会(IDSA)ガイドライン(2016)では、IPAのリスクがあり、原因不明の発熱がある患者、または抗生物質に反応しない下気道感染症の臨床像がある患者に対して、HRCTを実施することを推奨している。halo sign,、air-crescent sign、consolidationの中の空洞影などが特徴的。しかし、好中球減少症のない患者では、片側・両側の浸潤影、GGO、空洞影、tree-in-bud、胸水など見られることがある。halo signは一時的で早期に見られるのに対し、air-crescent signは後期に見られ、好中球の回復と壊死領域の線維化を反映している。
微生物学的特徴
培養
炎症を起こした組織や壊死組織内の真菌菌糸や、通常は無菌の身体部位からのアスペルギルス属菌の増殖を顕微鏡で観察することは、証明された IFD の診断におけるゴールドスタンダードである。これは現在、colonezationと侵襲性疾患を区別できる唯一の技術であるが、顕微鏡検査の感度はわずか50%である。培養、顕微鏡検査、抗原、DNA検出技術に使用できる気管支肺胞洗浄 (BAL) サンプル採取を伴う早期気管支鏡検査は、最も感度の高い診断アプローチである。
真菌BAL液(BALF)培養が陽性であれば、適切な宿主におけるIPAの証拠となるが、感度は低く(約30%)、IPAを除外するために使用できない。
血液培養は、全身性IAの場合でも、ほとんど陽性にはならない。
痰や気管吸引液の真菌培養が陽性の場合、コロニー形成を反映している可能性があるため、慎重に解釈する必要がある。
ガラクトマンナン
ガラクトマンナンは真菌の成長中にアスペルギルス (および他のいくつかの病原体) によって放出される真菌細胞壁多糖類である。血液またはBALF中のアスペルギルスGMの検出は、主に光学密度指数(ODI)として検出される酵素免疫測定法によって行われる。最も一般的に使用されているのは、ダブルサンドイッチELISA(Bio-Rad、Platelia、Marnes-la-Coquette、フランス)である。BALFでのGM検出の診断性能は良好で、カットオフODI 1.0を使用した場合、重篤な非好中球減少症患者でも許容できる感度と特異度がある。BALF での GM の感度は培養よりもかなり高い。適合宿主における ODI カットオフ 1.0 での血清 GM 陽性は血管侵襲の強い指標であるが、疾患経過の初期段階では感度が低く、特に好中球減少症のない患者では感度が低い。GM検査が陽性であれば、臨床的特徴や画像所見が現れる数日前に陽性反応が現れる可能性があり、早期診断につながる。
βDグルカン
βDグルカンは、多くの真菌の細胞壁の一部である。特異性が低いため、IAの診断には使用できず、現在EORTC/MSGERCの診断基準には含まれていない。GMまたはPCR検査と組み合わせると特異性が向上する。しかし、カルバペネム、アンピシリン-スルバクタム、一部のセファロスポリンなどの抗菌薬を投与した場合など、特定の状況では偽陽性が報告されている。
アスペルギルスPCR
BAL、血液、組織生検でアスペルギルスの DNA を検出するために PCR 検査を使用できる。しかし、PCR陽性では定着と侵襲性疾患を区別できないが、BALFでのPCR陽性は信用性が高い。血液検査でのPCRは感度と特異度は低くなる傾向があるが、2回連続してPCR陽性となると特異度が高まる。
侵襲性真菌感染症に対するEORTC/MSGERC定義
侵襲性真菌感染症に対する確実性に基づいて、proven, probable, possibleと分類される。
Provenは宿主のリスク要因や画像所見、患者の免疫状態に関係なく、真菌感染を決定づける陽性生検 (または無菌の部位からの陽性培養) と定義される。
GMを真菌学的基準としてprobable, possibleとみなす場合、ODIのカットオフ値は、特異度を向上させるために業者が提案したものよりも高くなっている(感度にはほとんど影響がない)。
Proven
| 顕微鏡的分析:無菌検体 | 培養:無菌検体 | 血液 | 組織核酸診断 |
| 穿刺吸引または生検によって得られた標本の組織病理学的、細胞病理学的、または直接顕微鏡検査で、関連する組織損傷の証拠を伴って菌糸またはメラニン化した酵母のような形態が見られるもの。 | 通常は無菌で、感染症の経過と一致する臨床的または画像所見的に異常な部位から無菌操作で採取した検体の培養による硝子状または色素性のカビの回収(BAL 液、副鼻腔または乳様突起洞の検体、および尿を除く)。 | 血液培養での真菌陽性。 | ホルマリン固定パラフィン包埋組織に真菌が見られる場合、PCR と DNA 配列解析を組み合わせた真菌DNA の増幅。 |
Probable
| 宿主因子 |
| ・侵襲性真菌感染症の発症と時間的に関連する好中球減少症(好中球数0.5×10 9個/L未満[好中球数500個/mm3未満]が10日間以上続いた)の最近の病歴 |
| ・血液悪性腫瘍(活動性悪性腫瘍、この悪性腫瘍の治療を受けている患者、および最近寛解した患者) |
| ・同種幹細胞移植を受けた |
| ・固形臓器移植を受けた |
| ・過去60日間に3週間以上、治療用量≥0.3 mg/kgのコルチコステロイドを長期使用(アレルギー性気管支肺アスペルギルス症の患者を除く)。 |
| ・過去90日間にカルシニューリン阻害剤、TNFα阻害剤、リンパ球特異的モノクローナル抗体、免疫抑制ヌクレオシド類似体などの他の承認されたT細胞免疫抑制剤による治療を受けた |
| ・ブルトン型チロシンキナーゼ阻害剤(イブルチニブなど)などの既知のB細胞免疫抑制剤による治療 |
| ・遺伝性の重度免疫不全症(慢性肉芽腫症、STAT3欠損症、重症複合免疫不全症など) |
| ・ステロイドによる第一選択治療に反応しない腸、肺、または肝臓に影響を及ぼすGVHDグレードIIIまたはIV |
| 臨床的特徴 |
| ・CT で以下の 4 つのパターンのいずれかが認められる場合: |
| 1 halo signの有無にかかわらず、密で境界明瞭な病変 |
| 2 Air crescent sign |
| 3 空洞 |
| 4 楔形および分節性または葉状の癒着 |
| 微生物学的証拠 |
| ・顕微鏡検査と培養 |
| ・喀痰、BAL、気管支ブラシ、吸引物からの培養により検出されたアスペルギルス属 |
| ・痰、BAL、気管支ブラシ、吸引物中からの顕微鏡的真菌示唆所見 |
| ・ガラクトマンナン抗原、以下のいずれか: |
| 1 単一血清または血漿: ≥1.0 |
| 2 BAL液: ≥1.0 |
| 3 単一血清または血漿: ≥0.7、BAL 液: ≥0.8。 |
| 4 脳脊髄液: ≥1.0 |
| ・アスペルギルスPCR、以下のいずれか: |
| 1 血漿、血清、全血のPCR検査が2回以上連続して陽性 |
| 2 BAL液のPCR検査が2回以上陽性 |
| 3 血漿、血清、全血で少なくとも1つのPCR検査が陽性であり、BAL液で1つのPCR検査が陽性である |
IPA、IAPA、CAPAの定義
AspICU
AspICUアルゴリズムは、3つの疾患カテゴリ (proven IPA、putative IPA、アスペルギルスcolonization)を区別し、呼吸器サンプルのアスペルギルス培養陽性をエントリー基準として使用。宿主因子の存在と画像所見に関する基準はそれほど厳格にはしていない。組織病理学的ゴールドスタンダード診断と比較すると、AspICUのIPAと推定される定義は、アスペルギルスのコロニー形成と侵襲性疾患を区別する感度92%、特異度61%に達する。このアルゴリズムの欠点は、血清または BALF GM 陽性を診断真菌基準として含めなかったため、アスペルギルス培養が陽性の場合にのみ使用できる。
IAPA Consensus Case Definition
2020年に、多分野の専門家パネルが専門家によるIAPAコンセンサス症例定義を発表し、患者をproven IAPAとprob able IAPAに分類した。このアルゴリズムは、血清GMに加えて、気道の可視化のためのBALによる早期気管支鏡検査、アスペルギルスGM検査、培養および顕微鏡検査の必要性を強調している。
CAPA: ECMM/ISHAM CAPA Consensus Criteria Followed by the Taskforce Report
2020年12月、ECMMとISHAMは、CAPAの診断と管理に関するECMM/ISHAM CAPA専門家合意基準を発表し、患者をproven、probable、possible CAPAに分類した。CAPAのpossbleとprobableの診断の最小要件は、1つの臨床所見 (例: 難治性の発熱または胸痛)、1つの画像所見、および1つの細菌学的基準の組み合わせである。
| 宿主因子 (細菌菌学的基準Bを満たせば、宿主因子は不要) | 臨床症状 | 画像所見 | 細菌学的基準 | |
| AspICU: 推定IPA | ・好中球減少 ・細胞毒性薬剤で治療された血液学的または腫瘍学的悪性腫瘍がベースにあり ・ステロイド治療(PSL換算で>20mg) ・先天性/後天性免疫不全 (細菌菌学的基準Bを満たせば、宿主因子は不要) | ・適切な抗生物質療法を少なくとも3日間受けても発熱が改善しない ・解熱期間が48時間を超えた後の再発性の発熱 ・胸膜炎による胸痛またはrub ・息切れ ・血痰 ・適切な抗生物質療法と人工呼吸器によるサポートにもかかわらず呼吸不全が悪化 | ・ポータブルXpまたは肺CTよる異常所見 | <基準A>下気道検体培養でのアスペルギルス陽性 <基準B>細菌増殖のないBAL液の半定量アスペルギルス陽性培養と、分岐菌糸を示す陽性細胞診塗抹標本 |
| IAPA expertコンセンサス:probable IAPA | ・ICU入院と時間的に関連するインフルエンザPCRまたは抗原検査の陽性 | ・呼吸困難のためICU入院 ・IATBの診断のための気管支鏡検査で気道プラーク、結節、痂皮、偽膜または潰瘍が認められる | ・あらゆる肺浸潤影+細菌学的基準Aを満たす ・空洞化浸潤(他の原因によるものではない)および細菌学的基準B | <基準A>血清GM指数 > 0.5またはBALF GM指数 ≥ 1.0またはBALF培養陽性 <基準B>喀痰培養陽性または気管吸引液培養陽性 |
| ECMM/ISHAM CAPA: probable CAPA | ・COVID-19 PCR検査陽性とICU入院の関連性 | ・呼吸困難のためICU入院 ・IATBの診断のための気管支鏡検査で気道プラーク、結節、焼痂皮偽膜または潰瘍が認められる | ・胸部CTでの浸潤影 ・他の原因に起因しない空洞浸潤 | ・BALF中の真菌成分の顕微鏡的検出 ・BALF培養陽性 ・血清GM >0.5または血清LFA >0.5 ・BALF GM ≥1.0 または BALF LFA ≥1.0 ・血液中のアスペルギルスPCR検査が2回以上陽性 ・BALF中のアスペルギルスPCRが1回陽性(<36サイクル) ・血液中のアスペルギルスPCRが1回陽性、BALF中のPCRが1回陽性 |
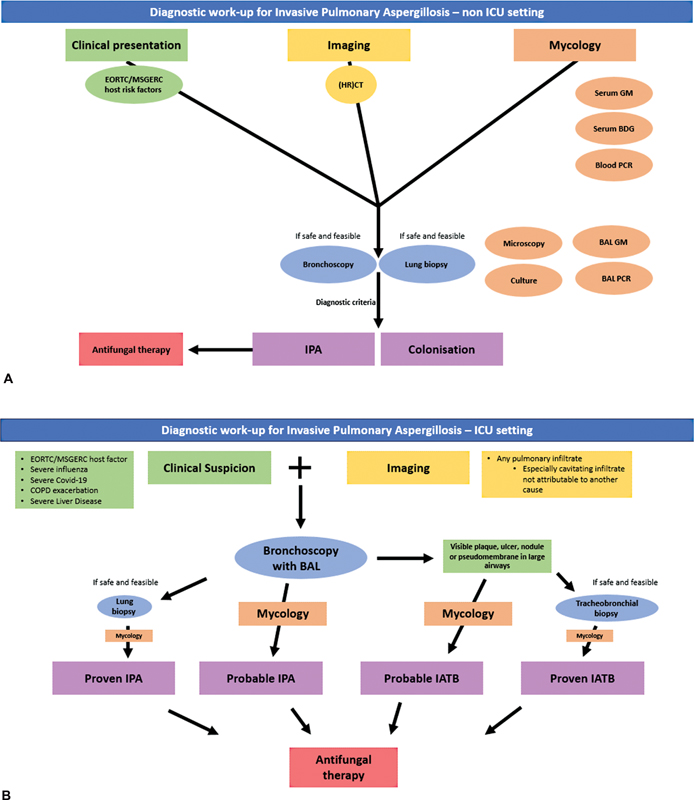
このreviewで提案されるIPA診断フローチャート
細菌学的分析に必要なBALF量はわずか(最大40mL)であり、気管支鏡検査は(人工呼吸器を装着した)重症患者では一般的に忍容性が高く、合併症のリスクも低い(腹臥位または体外式膜型人工肺装着患者でも)。
治療
FNおよび感染関連死亡発生率を低下させるためにCSFが使用される。
IDSA、ESCMID-ECMM-ERS、ECIL-6ガイドライン、最近更新されたオーストラリアのガイドラインでは、真菌活性アゾール(ボリコナゾール、イサブコナゾール、ポサコナゾール)による一次治療が推奨されている。イサブコナゾールとポサコナゾールは、ボリコナゾールより劣らず、薬剤関連の有害事象が少ないとされている。アゾールによる一次治療が禁忌の患者の場合、リポソームアムホテリシンB(AmB)が代替選択薬である。
治療期間としては、IDSAガイドラインでは、患者の特徴や臨床反応、免疫再構築、GVHDからの回復などの疾患の臨床的要因に応じて、最低6~12週間を推奨している。
イトラコナゾール、ボリコナゾール、ポサコナゾールには治療薬モニタリング(TDM)が推奨されているが、イサブコナゾールではルーチンには不要である。
すべてのアゾール系抗真菌剤は肝毒性と末梢神経毒性を示し、後者は長期曝露によるものである。イトラコナゾール、ボリコナゾール、ポサコナゾールはQTcを延長する。逆に、イサブコナゾールはQTcを短縮する。また、ポサコナゾールは偽性高アルドステロン症と関連している。
その他として、視覚障害や幻覚、皮膚がんや骨膜炎(どちらも長期の副作用)など、ボリコナゾールによる副作用もある。
Salvage therapy
難治性または進行性アスペルギルス症の治療は、salvage therapyとみなされる。治療失敗とは、患者のコンプライアンスがチェックされ、TDM によって適切な薬剤曝露が確認され、免疫再構築症候群が除外され、代替診断も除外されることを意味する。適切なアゾール薬レベルにもかかわらず、治療開始から10~14日後に画像所見的進行が見られる患者の場合、通常は気管支鏡検査を繰り返し、Mucorales属のDNAおよびアゾール耐性に関連する変異の存在について分子検査を実施 (または繰り返し)する。トリアゾール療法で十分な血清薬物濃度にもかかわらず進行している患者は、リポソーム AmBまたはエキノカンジンで治療できる。PCRで Mucorales属との合併感染を除外できない場合は、リポソーム AmBが望ましい。外科的介入の可能性も評価する必要がある。
一次予防
典型的なリスクとしては、長期にわたる重度の好中球減少症の患者、肺移植患者、重度のウイルス性肺炎で ICUにいる患者など、である。
例えば、AMLまたは骨髄異形成症候群の化学療法を受けている患者、またはグレード2以上のGVHDを有する同種HCTレシピエントにおけるIFDの予防において、ポサコナゾールはフルコナゾールやイトラコナゾールよりも効果的であることが示されている。
Pre-emptive approach
真菌活性予防法を受けていない高リスク好中球減少症患者において、バイオマーカー陽性または診断画像に基づいて抗真菌治療が開始される。これは、治療でカバーされるべき可能性のあるIFDの診断を意味する。この戦略は抗真菌薬の消費量を減らしながらかつ効果的であることが示されている。
真菌活性予防を受けていない高リスク患者における血清GMの2週間ごとの連続スクリーニングは、通常pre-emptive approachに含まれている。
画像フォローアップ
IPAは通常、治療開始後1週間以内に悪化することが知られているため、フォローアップCTスキャンは治療開始後2週間以内に行う。また、好中球の回復後または免疫抑制の漸減後の免疫再構築により病変が増加する可能性がある。臨床症状の悪化、別の診断の疑い、大血管浸潤などの合併症がある場合は、早期の画像検査が考慮されることがある。
まとめ
IFD、IPA、IAPA、CAPAに関しての全体的なレビューでしたね。
診断には、やはりBALが重要です。




コメント