Review article: Evaluation and care of the critically ill patient with cirrhosis
- Aliment Pharmacol Ther. 2024 May 1.
- doi: 10.1111/apt.18016.
- PMID: 38693712.
肝臓が悪いと重症患者の管理が難しくなります。ICU管理における評価、ケアにfocusしたレビューとなっています。
Introduction
肝硬変患者におけるICUへの入院の一般的な理由として、敗血症、循環不全、肝性脳症、静脈瘤出血、呼吸窮迫、AKI、肝腎症候群などがある。
静脈瘤出血、SBP、肝性脳症、など門脈圧亢進症に関連した合併症が60%程度を占め、残り40%は非肝臓関連 (敗血症など)である。
末期肝疾患 (ESLD) とその合併症は、Critical care settingでの死亡率が 43% ~ 87% 、侵襲的機械換気(IMV) を必要とする ESLD 患者の死亡率は 60% ~ 90% であり、1 年死亡率は 89% にものぼる。敗血症性ショックを呈した肝硬変患者では、病院での死亡率は 30% ~ 70% に及ぶ。
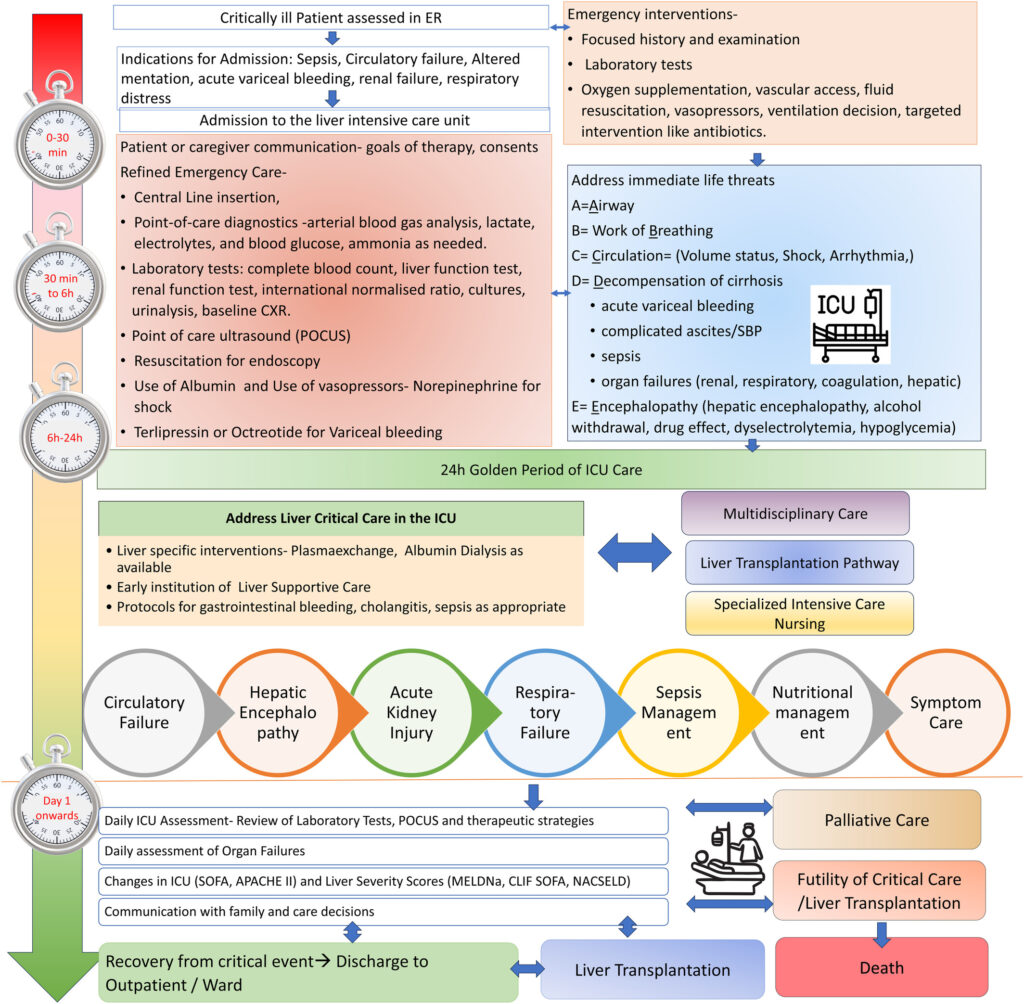
Figure1 は、救急病棟からICUに入院した重症患者の、入院時から退院または死亡までのアプローチと多面的な管理プロトコルを示している。
肝硬変の生理学
【循環】
肝硬変および門脈圧亢進患者では、RAA系亢進による水・Na貯留を引き起こし、腹水、胸水、血管外漏出による間質液増加を認める。また、心不全(収縮機能障害、拡張機能障害どちらも起こりうる。肝硬変性心筋症(cirrhotic cardiomyopathy)という既知の心疾患がない肝硬変患者の心機能障害という状態もある)、門脈肺高血圧症も起こりうる。
敗血症、全身性の炎症がある患者では、NO、エンドトキシン、インターロイキン(Il-1、Il-6)、TNFαなどの炎症性メディエーターに続発する循環不全が起こりうる。
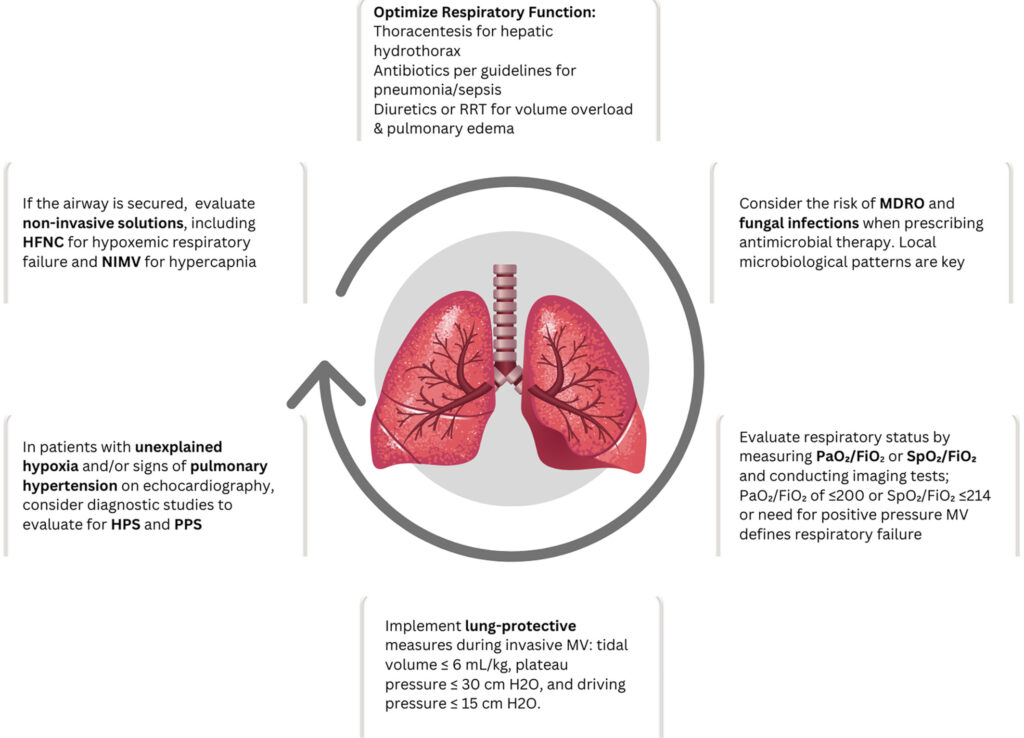
【呼吸】
肝肺症候群や門脈肺高血圧症、腹水貯留による換気障害を引き起こす。
【腎臓】
AKIは、「sCrが0.3mg/dL以上または50%以上上昇し、sCrが1.5mg/dL以上であること。そして、それが過去7日間に発生したと推定または分かったもの」と定義されている。
HRS-AKIの定義では、HRS-AKIの新しい定義では、血清クレアチニン≧1.5mg/dLのカットオフ値が、48時間以内の血清クレアチニンの0.3mg/dLを超える上昇に置き換えられている。
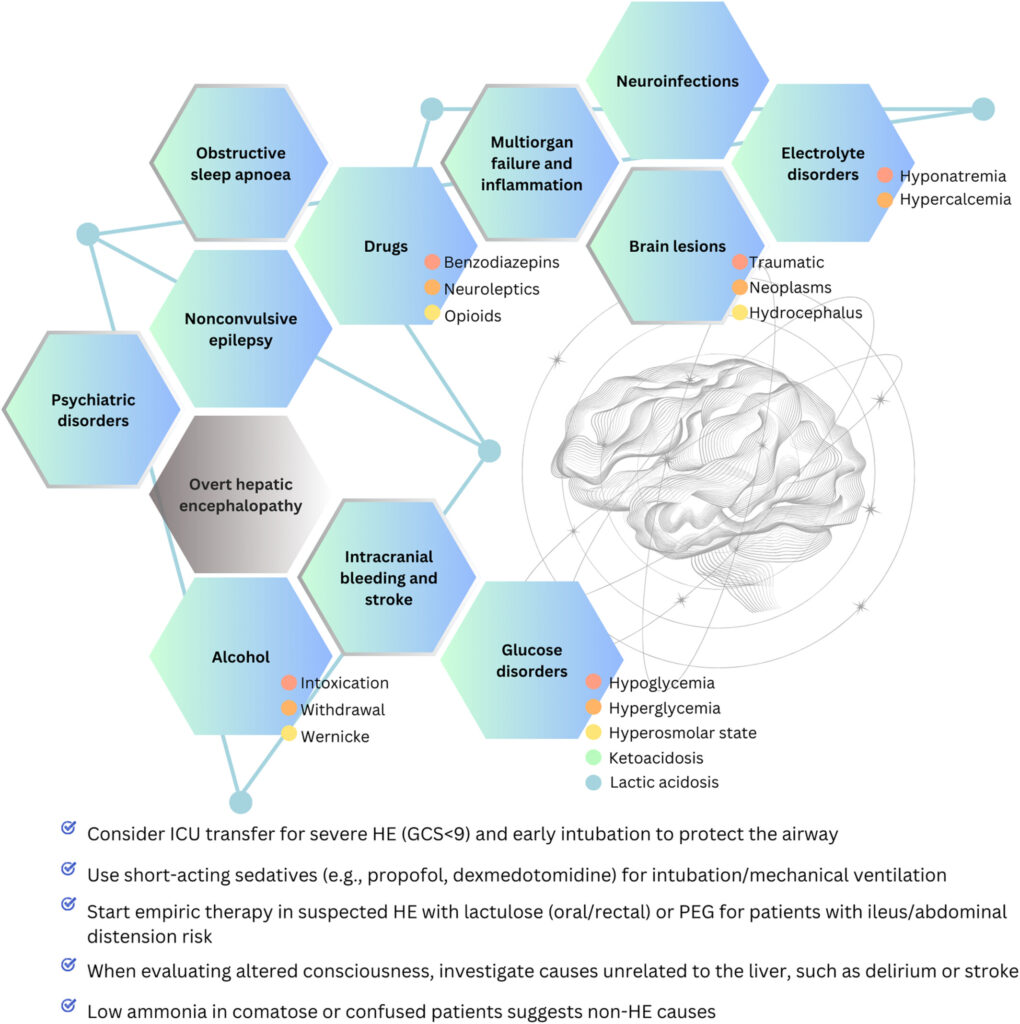
【神経】
肝性脳症に起因するものもあれば、そうでないものもある。肝障害の原因疾患そのものによっても神経症状が出ることもある。以下は肝性脳症の鑑別疾患である。
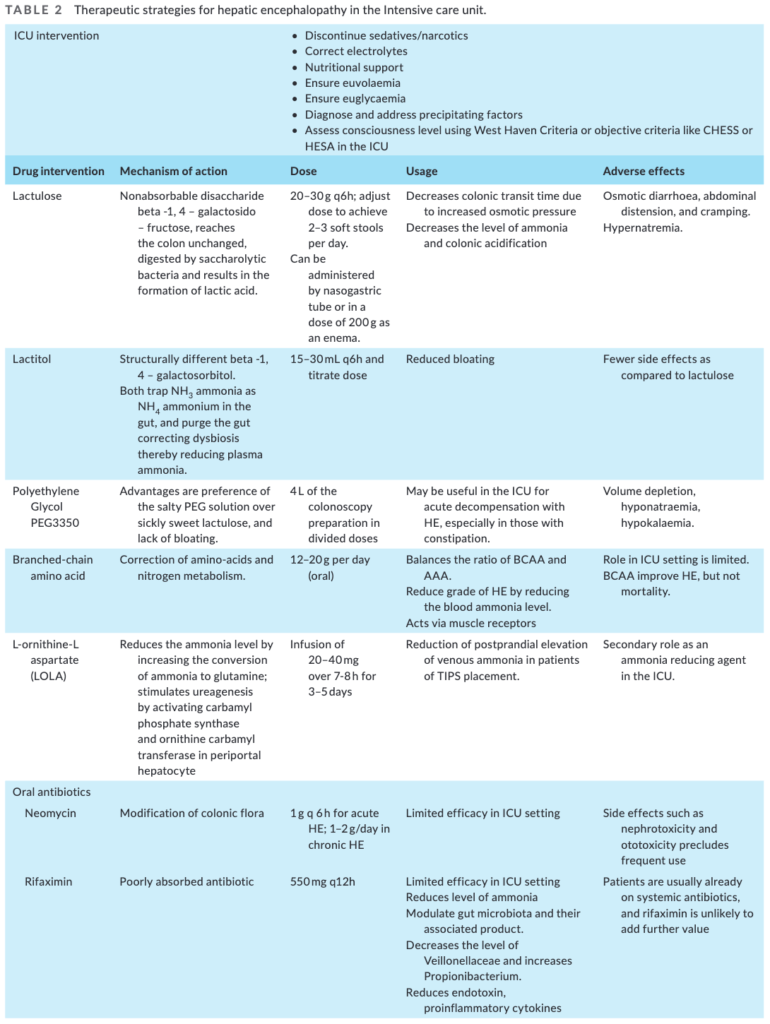
肝性脳症の治療についてはこちら。
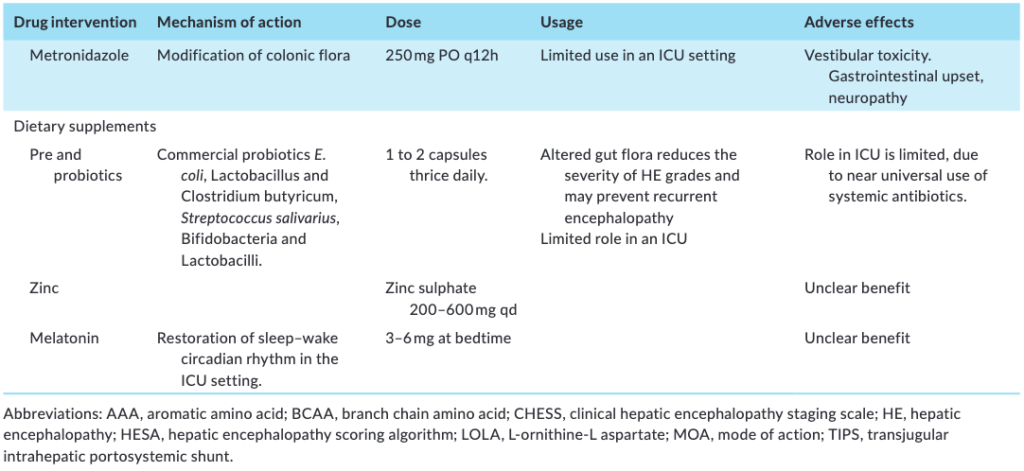
【栄養】
高アンモニア血症は筋肉の消耗に大きく寄与し、複数の経路を通じて筋肉の変性を促進する。骨格筋内のアンモニアの上昇はNF-κβを誘発し、ミオスタチンの発現を増加させると同時に筋形成を阻害し、オートファジーを促進する。骨格筋におけるグルタミン合成を介したアンモニアの除去により、代謝経路内での消費により血漿分岐鎖アミノ酸(BCAA)が減少する。BCAA の枯渇は筋肉量の減少と関連している。高アンモニア血症は、ミトコンドリアの機能不全や筋肉組織の酸化ストレスも誘発する。
【血液凝固】
肝硬変患者、特に低アルブミン血症患者では、VTEリスクが高く(AR0.5-2%)、門脈血栓症の発生率は年間約8%である。
【感染】
真菌感染症は肝硬変関連感染症の3-15%を占める。カンジダは肝硬変患者の血流感染の7-9%であり、侵襲性アスペルギルス症も多くなってきている。
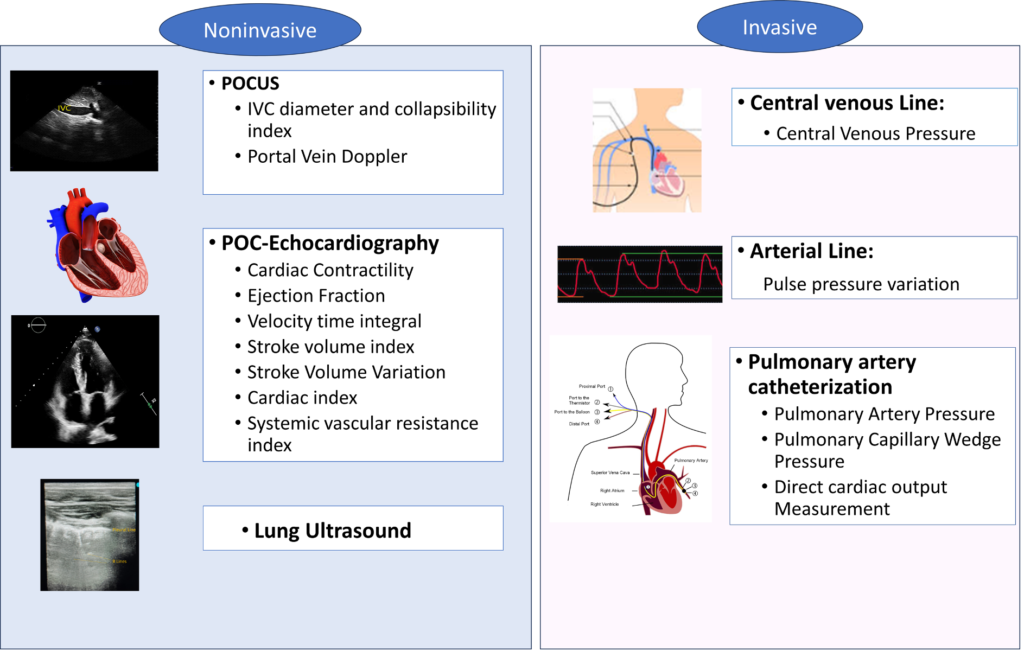
【血行動態評価】
ICU領域ではエコーでの血行動態評価が有用になる。もちろん侵襲的なモニタリング(CVP、Aline、肺動脈カテなど)も有用。CVPはvolume overloadを適切に評価できない可能性があるので単独の指標とするのは注意が必要。
治療
【HRS-AKI】
20% アルブミン (20 ~ 40 g/日) 投与後のテルリプレシンは、HRS-AKI の第一選択治療となっている。ACLF では、HRS-AKI 患者においてテルリプレシン(日本では未承認)はノルアドレナリンの使用よりも生存率を向上させる(Hepatology. 2020;7:600-610.)。
【食道静脈瘤】
テルリプレシンは、初回用量2mg を 4時間ごとに静脈内投与し、出血コントロールが付いたら1 mgを静脈内投与する。オクトレオチドはテルリプレシンの代替品であり、ボーラス投与 (50μg IV) に続いて持続注入 (50μg/hr) として投与する。これらの薬物療法は通常、出血の停止後 2 ~ 5 日間継続する。
輸血に関しては、Child-Pugh分類A/B肝硬変の患者では、制限的輸血戦略(閾値7 g/dL、目標7~9 g/dL)の方が、寛大な輸血戦略(9 g/dL 閾値、目標 9~11 g/dL)よりも6週間後生存率が有意に高かった。なお、Child-Pugh分類Cでは有意差は認められなかった(N Engl J Med. 2013;368:11-21.)。
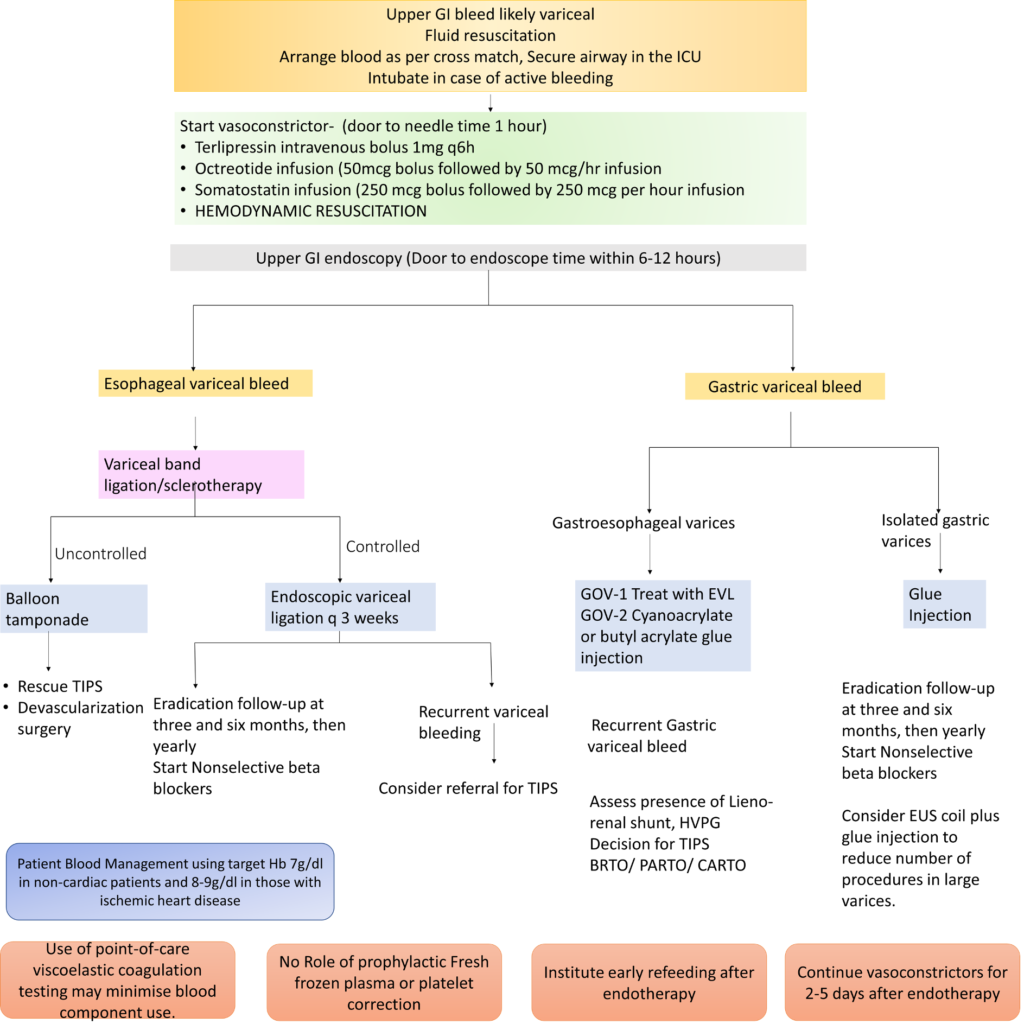
【腹水穿刺】
穿刺による循環不全の予防として20%Alb投与(腹水1Lあたり8g投与)を検討。
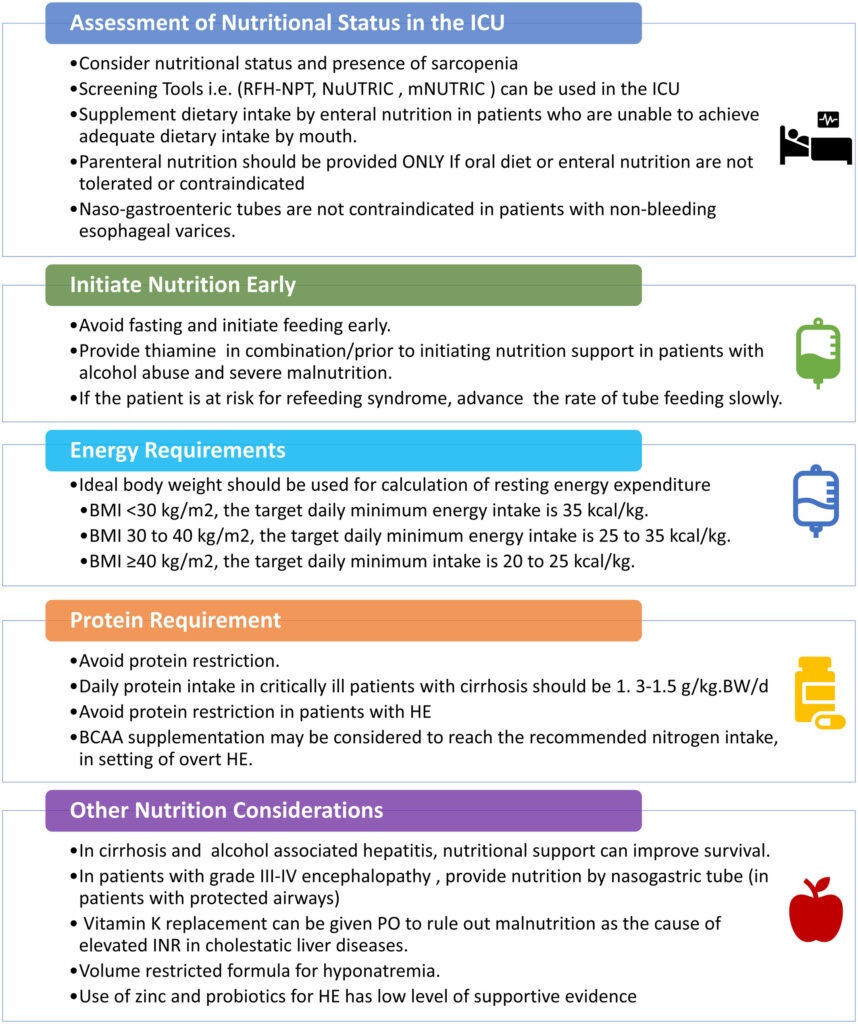
【栄養管理】
理想的には、1 日あたり理想体重あたり35-40kcal、または安静時エネルギー消費量 (REE) の1.3倍のエネルギー摂取量を目標とすべき。
重症の肥満患者はカロリー制限をすべきではなく、状態が安定したら、タンパク質摂取目標を2.0g/kg/日とし、25~30kcal/kg/日を摂取する必要がある。
経口栄養を摂取できるが、48-72時間経過しても必要カロリーの50%を満たせない患者には、経管栄養での追加投与を検討。
【移植】
ACLFの場合、特にACLF発症から28 日以内の早期肝移植は生存率を著しく改善する。3日目から7日目までの ACLF の重症度は、移植の結果に影響を与える重要な要因とされる。具体的には、この期間中に ACLF グレード2および3で、28日以内に肝移植を受けた患者は、6か月時点で81%の生存率を示し、移植を受けなかった患者の生存率は10%である。
LT の不適合を示唆する臨床指標として、4 つ以上の臓器不全の存在、3-7日目までの高いCLIF-Cスコア、呼吸不全によるMVの必要性、乳酸値の上昇などが含まれる。
さらに、活動性胃腸出血や重大な昇圧剤の必要性などの重度の合併症により、グレード2または3のACLF患者が移植不適応と分類されうる。204
Clinical FrailtyスコアやFutilility Riskスコアなどの補助ツールは、移植の適応の可否についての補助的なツールとなる。
まとめ
肝硬変患者がICUに入るほどのステータスになると死亡率が非常に高いです。治療方針、ACPなどを考慮して、上記治療を進めていければ良いですね。









コメント