- Acute and Critical Care 2024 August 39(3):331-340
- https://doi.org/10.4266/acc.2024.00647
CIRCIについてのガイドラインがありましたのでご紹介します。
Introduction
内因性コルチゾールを含むグルココルチコイドは、炎症細胞の産生と活性を抑制し、他の体内区画への再分布を促進することにより、主に抗炎症作用と免疫抑制作用を発揮し、その結果、循環免疫細胞全体が減少する。
副腎皮質ステロイドは、消化管で効率よく吸収され、高い蛋白結合性を示し、肝代謝を受け、腎臓から排泄される。
重症関連副腎皮質ステロイド分泌不全症(CIRCI)は、HPA軸の機能低下、コルチゾール代謝の変化、および組織コルチコステロイド抵抗性による副腎不全を特徴とする。
非CIRCI患者に比べ28日死亡率が高いことに加え、外傷後のCIRCI患者の死亡率は34%であった。非生存者は高齢(65歳以上)であり、入院時により重度の基礎障害があり、人工呼吸を必要とする日数が長く、敗血症、菌血症、肺炎の発生率が高かった(J Trauma Acute Care Surg 2014;76:1390-6. Am Surg2011;77:579-85. Sci Rep 2023;13:5433.)。
病態生理学
重篤な疾患は著しい生理的ストレス反応を引き起こし、ホメオスタシスを維持するための様々なメカニズムを活性化させるが、重要な機序のひとつに、HPA軸の活動の亢進があり、生存に不可欠な全身のグルココルチコイドレベルを急速に上昇させる。
古典的なモデルでは、重症患者におけるストレス因子は、視床下部傍室核に作用してコルチコトロピン放出ホルモン(CRH)とアルギニン・バソプレシン(AVP)を放出する神経細胞シグナルと炎症性シグナルからなる。CRHとAVPは下垂体前葉に輸送され、副腎皮質刺激ホルモン(ACTH)を副腎皮質細胞から全身循環に放出させる。ACTHの影響を受けて、副腎はコレステロールからグルココルチコイド(コルチゾール)、ミネラルコルチコイド(アルドステロン)、副腎アンドロゲン(デヒドロエピアンドロステロン)を合成する。副腎ミトコンドリアはまた、副腎皮質細胞内でのステロイド生成において極めて重要な役割を果たし、細胞内コレステロールのコルチゾールへの変換を促進する。コルチゾールはその後、多くの細胞に全身的な作用を及ぼし、炎症、心血管機能、代謝を調節する。
しかし近年、この伝統的なモデルは批判にさらされるようになり、重症患者におけるコルチゾール濃度の上昇は、必ずしも血漿ACTHの高濃度と一致しないことが明らかになっている。現在では、HPA軸の調節障害、コルチゾール代謝の変化、グルココルチコイドに対する組織の抵抗性が、CIRCIにおける3つの主要な病態生理学的事象であると考えられている。
<HPA軸の機能不全>
中枢性HPA軸の古典的な活性化モデルは、敗血症や重篤な疾患に反応してACTH値が上昇し、副腎皮質コルチゾール産生が亢進することを特徴とする。血漿中ACTHの上昇は、重症患者では一時的にしか観察されないが、その後、少なくともICUでの最初の1週間は、血漿中ACTHは常に正常値以下に維持される。
最近の研究によると、ICUで4週間以上過ごす患者は、中枢性AIに似たHPA軸の抑制が見られることがある。HPA軸のストレス反応の強度や持続時間が調節不全になると、平衡が崩れてCIRCIに至る。
<コルチゾール代謝の変化と負のフィードバック阻害>
重症患者では、肝臓と腎臓におけるコルチゾールの分解が減少する。これは、抑制されたコルチゾール代謝酵素の発現と活性によるものであり、コルチゾールの半減期の延長と高コルチゾール血症を伴う。さらに、コルチゾールは、血漿結合タンパク質であるトランスコルチンおよびアルブミンの肝臓合成の減少およびこれらのタンパク質へのコルチゾール結合の減少により、これらのタンパク質から放出される。この反応は、アネキシンA1の発現を介した負のフィードバックループによるものである。下垂体レベルでの負のフィードバック抑制には、グルココルチコイド受容体への遊離コルチゾールの結合、または胆汁酸などのグルココルチコイド受容体の他のリガンドの結合も関与している可能性がある。敗血症の際のプロホルモン変換酵素1という酵素の発現低下も、POMCからACTHへの変換の低下に寄与している。
<組織抵抗性>
CIRCIはグルココルチコイドに対する組織の抵抗性によっても引き起こされる。
また、敗血症患者から得た血清は、細胞培養においてグルココルチコイド抵抗性を誘導することから、敗血症におけるグルココルチコイドに対する細胞レベルの抵抗性の潜在的メカニズムが示唆される。
<薬剤誘発性CIRCI>
グルココルチコイド、オピオイド、ケトコナゾールなどのアゾール系抗真菌薬、精神作用薬物、などは、ACTHの合成を抑制する可能性がある。
外因性グルココルチコイドの投与は、視床下部におけるCRHの産生および下垂体におけるACTHの分泌を抑制することにより、HPA軸に対して負のフィードバック制御を行う。
この抑制は副腎皮質の低栄養と萎縮を引き起こし、ミネラルコルチコイド活性を維持しながらコルチゾール産生を著しく低下させる。
その結果、グルココルチコイド療法を中止すると、副腎は十分なレベルのコルチゾールを産生できなくなり、AIが生じる。グルココルチコイド療法の突然の中止または急速な中止は、AIの症状を促進することがある。
オピオイドは、主に視床下部のレベルでHPA軸を阻害し、コルチゾールの産生を減少させることにより、同様の方法でAIを誘発する可能性がある。
ベンゾジアゼピン系薬剤は、HPA軸の中枢および末梢の様々なポイントにわたって機能を阻害することにより、コルチゾール産生の急激な低下に寄与する。
エトミデートを投与すると、コルチゾール合成の最終酵素段階が阻害され、重症患者において投与後4~6時間と12時間の両方で副腎不全が生じる可能性が著しく高まる。イミダゾール系抗真菌薬でクッシング症候群の治療選択肢であるケトコナゾールは、副腎ステロイド生成の重要な酵素を標的として阻害する。急性副腎不全はまた、別の抗真菌薬であるフルコナゾールによる治療を受けた患者、特に重篤な患者で観察されている。
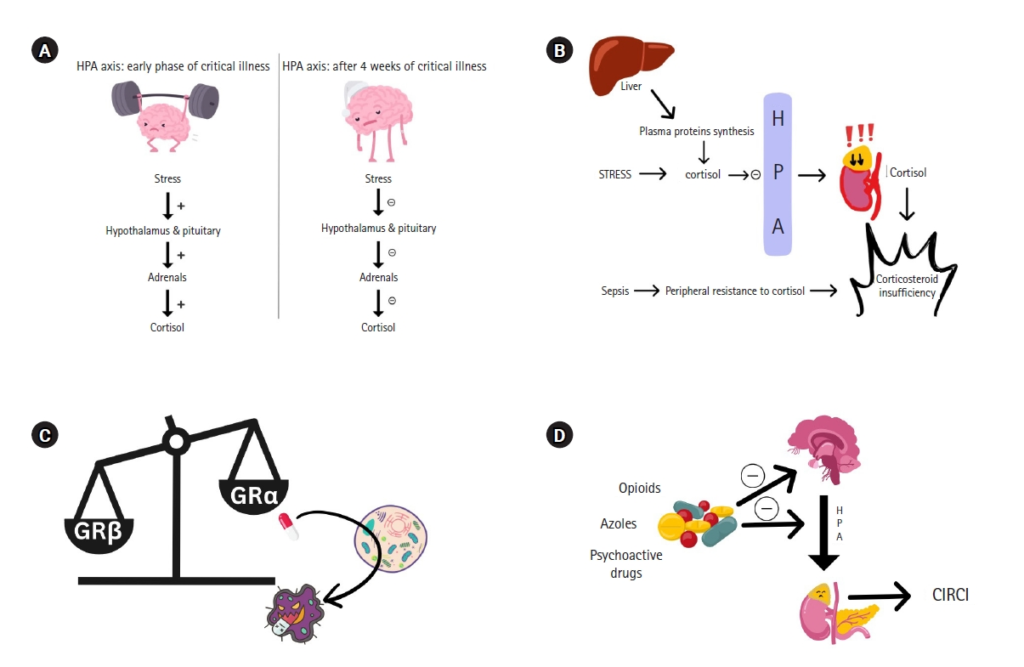
重症関連副腎皮質ステロイド分泌不全(CIRCI)の病態生理。(A)重症時の視床下部-下垂体-副腎(HPA)軸反応の変動。(B)コルチゾール代謝の変化、HPA軸の抑制、コルチゾールに対する末梢抵抗性。(C)コルチコステロイドに対する組織抵抗性。(D)薬剤誘発性CIRCI。GRα:グルココルチコイド受容体α;GRβ:グルココルチコイド受容体β。
症状および診断
CIRCIの徴候や症状には、疲労、体重減少、失神、発熱、錯乱、傾眠、背中や脚のけいれん、姿勢性めまい、低血圧などがある。重症例では、血液量減少性ショックや昏睡が起こることがある。脳症、鎮静中止後の神経学的回復不良、持続的な血管収縮薬の必要性などの特徴は、CIRCIを疑うべきである。
原発性副腎不全(PAI)が疑われる症例では、コルチゾール欠乏症の刺激性検査を行うべきである。PAIの確認には、通常、血漿ACTHの上昇を伴う朝のコルチゾール値が140nmol/l(5μg/dL)未満であることが必要であり、その後、250μgのシナクテン(副腎皮質刺激ホルモンアナログ)刺激試験を行う。
低コルチゾール血症が確認された患者では、ACTH値が66pmol/l(300pg/ml)を超えるとPAIの可能性が示唆される。低用量および高用量のシナクセンを用いた刺激試験は、診断の助けとなる。レニンとアルドステロンの同時測定は、鉱質コルチコイド欠乏症の確認に推奨される。二次性AI診断には、動的刺激性試験が必要であり、インスリン負荷試験がそのゴールドスタンダードである。米国クリティカルケア医学会は、ランダムコルチゾール<10μg/dl(275.9nmol/L)の患者でAIを考慮することを提案している。
4週間以上ICUで機械的および薬理学的支援を必要とする重症患者、特に十分な蘇生とバソプレッサー支援にもかかわらず血行動態が不安定な患者は、CIRCIのリスクがあると考えるべきである。さらに、HPA軸またはコルチゾール合成に影響を及ぼす薬物への曝露は、CIRCIの疑いを強める。
CIRCIの検査所見には、低ナトリウム血症、クレアチニン値上昇、正常色素性貧血、リンパ球増加、好酸球増多、低血糖、軽度の高カルシウム血症などがある。また、コルチゾール値が正常または低値、アルブミン値およびコルチゾール結合グロブリン値が低値、ACTH値が正常または低値、胆汁酸値およびビリルビン値が高値を示すことがある。ICU入室時およびICU滞在期間中のTNF、インターロイキン(IL)-1β、IL-6などの炎症性サイトカイン値の上昇は、疾患の重症度および死亡リスクの上昇と相関する。
米国クリティカルケア医学会(American College of Critical Care Medicine)による2008年のタスクフォースガイドラインによると、ACTH刺激後の血清総コルチゾール値が9μg/dl未満、またはランダム総コルチゾール値が10μg/dl未満であることが重症患者のAI診断に信頼できるとされていた。しかし、これらの基準は臨床で広く採用されたわけではなく、2017年の最近のガイドライン更新では、これらの特定の検査の使用は含まれていない。その代わり、内分泌学会は、CIRCIの診断において、高用量(250μg)ACTH刺激試験が、血漿または血清遊離コルチゾール、唾液遊離コルチゾール、低用量ACTH刺激、ヒドロコルチゾン値(50~300mg)、コルチコトロピン値などの他の検査よりも優れていることを確認している。高用量ACTH刺激で30分または60分後の血漿中総コルチゾールのピーク値が18μg/dL未満であれば、CIRCIの診断は確定的と考えられる。
しかし、CIRCIに関する新しい病態生理学的証拠が診断に影響を及ぼしている。例えば、分布コルチゾール量の増加とコルチゾール結合グロブリンの抑制は、古典的な250μg ACTH刺激試験を無効なものにする可能性がある。これらの病態生理学的変化により、ACTH注射に対する血漿中総コルチゾールの増加反応が抑制されるため、刺激試験の結果は混乱する。ACTH刺激試験はAIのマーカーとして用いることはできないが、コルチゾール反応が低いことは、疾患の重症度の上昇を反映している。
治療
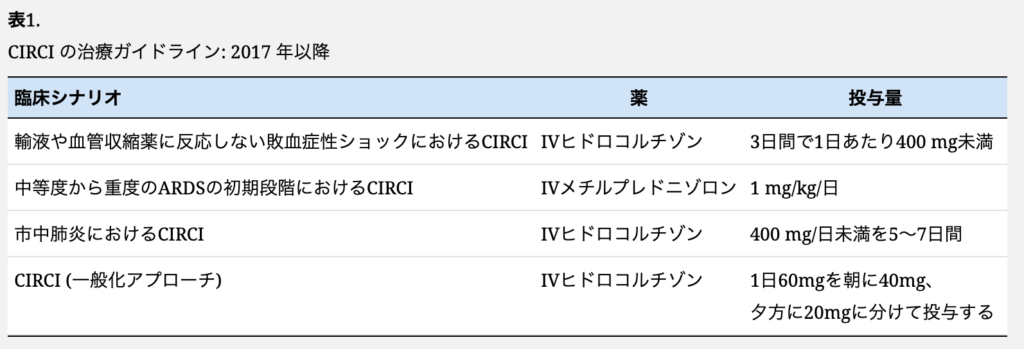
CIRCIが正確に診断されれば、集中治療とヒドロコルチゾンによる治療が推奨される。しかし、CIRCIを管理し死亡を予防するために必要なヒドロコルチゾンの正確な投与量は不明である。従来、ICUの重症患者には1日200~400mgの投与が推奨されていた。これは、標準的な代用量または補充量の約10~20倍に相当する。この用量の背景には、健康なHPA軸を持つ人が重度のストレスに関連する血漿濃度の上昇を生じるのに必要な1日のコルチゾール必要量を満たすという仮定があった。
Marikらによる2008年の研究では、敗血症性ショック症例におけるCIRCIのヒドロコルチゾン管理レジメンが推奨されている。この推奨は、敗血症性ショック症例に対して、ヒドロコルチゾン200mg/日を4回に分けて投与するか、240mg/日(10mg/時)の速度で持続点滴を少なくとも7日間行うというものであった。この研究では、特に重症の初期ARDS患者には、メチルプレドニゾロンを体重1kgあたり1mgの1日投与量で少なくとも14日間投与することも推奨している。グルココルチコイドは突然中止するのではなく、徐々に漸減することが必要である。敗血症、低血圧、酸素化悪化の症状が再発した場合は、治療を再開すべきである。デキサメタゾンはCIRCIの治療には推奨されない。敗血症性ショックに罹患し、輸液蘇生やバソプレッサー療法などの標準的治療に反応しない患者に対しては、400mg/日以下の用量のヒドロコルチゾンを最低3日間静脈内投与することが推奨されている。2018年の研究では、ヒドロコルチゾン+フルドロコルチゾンのレジメンは、敗血症性ショック患者においてプラセボと比較して90日全死因死亡率を低下させることが明らかになった。同様に、初期の中等度から重度のARDS患者には、1mg/kg/日のメチルプレドニゾロンの静脈内投与が推奨される。市中肺炎で入院した患者には、コルチコステロイドを1日量400mg未満のヒドロコルチゾン静注または同等量で5~7日間投与することが推奨される。副腎皮質ステロイドは、細菌性髄膜炎の患者や心肺バイパス手術を受ける患者にも推奨される。心停止では、副腎皮質ステロイドの使用が推奨される。成人のインフルエンザ患者には副腎皮質ステロイドを投与すべきではない。
Téblickらによる2022年の研究(J Clin Endocrinol Metab 2022;107:2057-64.)では、CIRCIを管理するためのより一般的なアプローチが提案されており、1日60mgのヒドロコルチゾンレジメンを朝40mg、夕方20mgの2回に分けて静脈内投与することを勧めている。これは、重症患者で乱れる正常な日内リズムを再現するものである。CIRCIに対するコルチコステロイド治療が開始されたら、投与は最低有効維持量まで漸減すべきである。投薬の中止はできるだけ早く行う。
重症患者への副腎皮質ステロイド投与は、慎重な検討が必要な重大な副作用を伴う。これには、グルコースホメオスタシスの破綻による高血糖、腎機能の変化による高ナトリウム血症および体液貯留、免疫抑制による院内感染感受性の増大などが含まれる。副腎皮質ステロイドの使用は、せん妄やICU後天性虚弱の発症などの精神神経系の合併症にも関連している。
まとめ
少なくともCIRCIを認識しないことには治療が開始されません。低血圧、低Na、低血糖などから疑うようにしましょう。









コメント