Neuroprognostication After Cardiac Arrest
- https://doi.org/10.1016/j.chstcc.2024.100074
ROSC後の神経学的評価はいまだに難しいですね。これからもエビデンスが蓄積されていくとは思いますが、現時点でのまとまったものがあったので共有します。
心肺停止後の初期治療と評価について
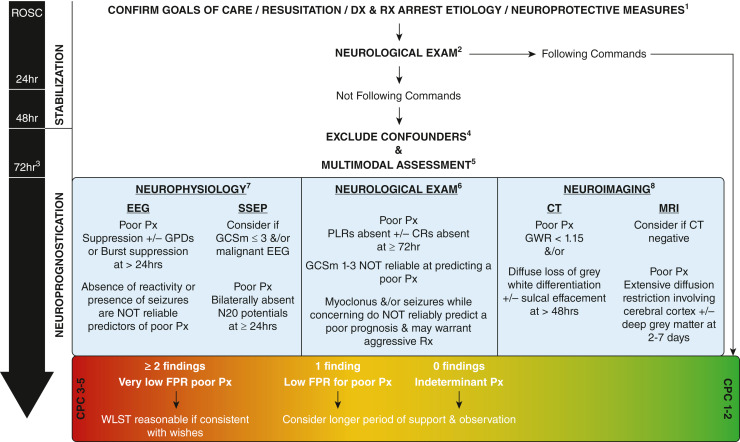
Figure 1Multimodal approach to post-arrest neuroprognostication. Details of immediate post-ROSC care. Neurologic examination findings that do not have acceptable false-positive rates for predicting a poor prognosis during early phases of care but indicate which patients warrant further neuroprognostication, timing, exclusion of confounders, multimodal approach, neurologic examination findings, neurophysiologic testing, and neuroimaging are referenced throughout the manuscript. CPC = Cerebral Performance Category; CR = corneal reflex; Dx = diagnosis; FPR = false-positive rate; GCSm = Glasgow Coma Scale motor score; GPD = generalized periodic discharges; GWR = gray-white ratio; PLR = pupillary light reflex; Px = prognosis; ROSC = return of spontaneous circulation; Rx = treatment; SSEP = somatosensory evoked potentials; WLST = withdrawal of life-sustaining therapies
神経学的転帰はCPCやModified Rankin Scakeというスケールを使用。
以下はhttps://motoyawata.clinic/blog/mrs-cpc/より引用させていただきました。

ROSC後からは、治療目標の確認、状態の安定化、二次的脳損傷の緩和に重点を置きながら、同時に心停止の原因を解明して介入可能な病態を特定することを目指す。
ガイドラインでは、治療的低体温療法を受けない患者では ROSC 後少なくとも 72 時間まで、治療的低体温療法を受ける患者では復温後 72 時間まで、予後判定を延期することを推奨している。
この間、すべての交絡因子を最小限に抑えるか排除することが重要である。鎮静剤、家庭用医薬品、および鎮静作用のある薬物は、十分な時間をかけて消失させる必要がある。薬物が完全に消失するように、少なくとも半減期の 5 倍待つことが推奨されるが、鎮静剤の状況依存的な半減期や、腎機能障害および肝機能障害の影響も考慮する必要がある。
そして、予後不良因子の判定は、mulimodalアプローチで行われる必要があり、予後不良の指標が1つだけ、の場合は、偽陽性と判定するリスクが高くなるため、注意が必要。
<対光反射>
対光反射が72 時間後に両眼に見られない場合、神経予後予測へのmutimodalアプローチの一部として、機能的転帰不良の信頼できる予測因子となる。主観的評価ではばらつきがでるため、定量的瞳孔測定器の使用が推奨される。定量的瞳孔計は赤外線と可視光を組み合わせて、瞳孔の最大および最小サイズ、収縮率と速度、拡張速度、神経学的瞳孔指数(0~5のスケールで瞳孔機能を数値的に理解するために使用する独自のアルゴリズム)を含む、対光反射のすべての要素を捕捉する小型のポータブルデバイスである。
<角膜反射>
毎日評価する必要がある。適切な手法が最も重要であり、感度が最も高い手法としては、虹彩の縁に触れ、瞬き反射を観察する、という手法が重要。しかし、心停止後 72 時間で両側に対光反射がないこと自体が機能的転帰不良の独立した予測因子として信頼できるものではない。心停止後 72 時間以上経過して両側の対光反射と角膜反射の両方が消失している場合、不正確な評価による偽陽性の可能性が軽減されるため、どちらか一方のみの所見よりも予後不良を予測する精度が高くなる。
<その他の神経所見>
眼球頭位反射/前庭反射、嘔吐反射、咳反射などの他の検査所見は、信頼できる指標ではない。
GCS M1/2/3は、特に初期には特異性に欠けるため、予後不良を予測するために使用すべきではない。
ミオクローヌスは、心停止後に見られる、突然、自発的、不随意、短時間、不規則、ショックのような筋肉群の収縮である。これは患者の 16% ~ 37% に発生し、低酸素脳症誘発性の神経活動亢進によって引き起こされる。これまでは、早期発症型ミオクローヌス(びまん性または局所性)は、予後不良の独立した指標とみなされていたが、臨床的および電気生理学的所見の両方においてミオクローヌスに著しいばらつきがあるため、ガイドラインでは信頼できる予後ツールとして認識されなくなった。たとえば、重積ミオクローヌスは、ROSCから48時間以内に発生する、自発的、持続的(30分以上持続)、多焦点性、または全身性ミオクローヌスとして臨床的に定義されることが多い。ランス・アダムス症候群は、動作または刺激誘発性ミオクローヌスの一種であり、良好な神経学的転帰と関連している。心停止後、意識を回復する可能性がある患者のミオクローヌスの臨床的特徴は、非同期性、多焦点性、非定型性(痙攣ごとに同じではない)、および遠位四肢を伴うものである。
EEGでは、rhythmic and periodic patterns (RPPs)が患者の10-35%に見られるが、多くの場合、ictal-interictal continuum (IIC)である。これらを治療対象とするかは、まだ分かっていない。ただし、心停止後の脳波で発作または非全般性周期性放電 RPP が確認された場合、特にそれが継続的で抑制されていない背景で発生した場合、他の客観的な予後指標を探しながら二次的な脳損傷を軽減することを目的として、麻酔薬または抗てんかん薬でこれらのパターンを抑制することを検討するのが妥当。予後不良の指標が存在しない場合は、他の医学的関連情報 (患者の年齢、併存疾患、他の進行中の医学的問題など) を考慮して、これらの EEG パターンの継続的な積極的な治療を検討する必要がある。予後不良の他の指標が存在する場合、RPP パターンは損傷した脳の随伴現象である可能性がある。
EEG の最も重要な交絡因子は鎮静剤 (プロポフォール、ベンゾジアゼピン、ケタミンなど) 。これは、高用量では、予後不良を誤って示唆する可能性のある懸念すべき EEG パターンが生じる可能性があるためである。予後判定のために EEG を施行する場合、鎮静剤の影響が懸念されなくなったときに EEG を実施する必要がある。
<SSEP>
SSEP は、脊髄後柱-毛様体経路を評価し、末梢、脊髄、皮質下、皮質レベルで電位が存在するかどうかを判定する。最も一般的に研究されているのは、正中神経に電気刺激を加えた後に一次体性感覚皮質で生成される N20 電位である。ガイドラインではさまざまな時点 (24 時間後および 48 時間後) が推奨しているが、交絡因子 (脊髄損傷など) なしで適切に実行および解釈された場合、mutimodalアプローチの一部として使用される場合の両側の N20 電位の欠如は、機能的転帰不良の信頼できる予測因子と見なされる。SSEP が最も役立つ可能性が高い患者は、心停止後も昏睡状態が続き、痛み刺激に対して意図的な動きを示さない患者である (GCS M3以下)。SSEP は従来、EEG や神経学的検査と比較して鎮静剤や麻薬による交絡が少ないと考えられているが、これらの薬剤は皮質電位潜時を延長し、振幅を低下させる可能性がある。
<画像検査>
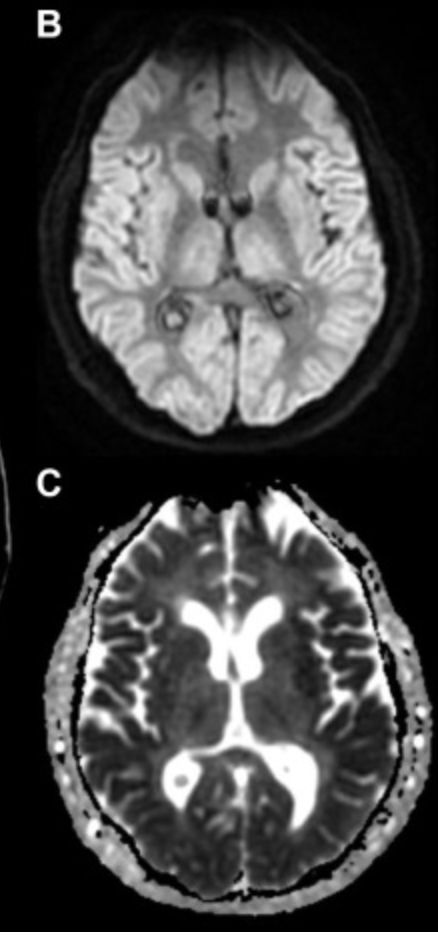
神経予後を予測するための画像診断は、心停止後少なくとも 48 時間までは行わない。CT スキャンと MRI はどちらも予後不良を予測する偽陽性率が低く、低酸素脳症と一致する所見については CTの方が特異性が高く、MRIの方が感度が高い。
CTでは、低酸素脳症の徴候として、皮質または深部構造における皮髄境界不明瞭、脳溝消失を伴う全身浮腫、脳室サイズの縮小、または基底槽消失、または偽くも膜下出血徴候 (すなわち、真のくも膜下出血を模倣する重度の脳浮腫に起因する脳物質の減衰の減少によって引き起こされる基底槽内の明らかな減衰の増加) が含まれる。
MRIでは、両側のびまん性の大脳皮質と深部灰白質 (視床と基底核) がDWIで高信号、ADCで低信号に見られる。
まとめ
神経学的予後評価には、mulimodalアプローチが必要ですね。単一の指標をもって、予後不良というのは言い過ぎであり間違った治療戦略になりかねません。









コメント